治疗药物监测为“全球药王”保驾护航
治疗药物监测为“全球药王”保驾护航
全球药王,全球第一个全人源单克隆抗体,2020年全球销售额200亿美元,自2012年以来已经连续9年蝉联全球畅销药物榜单排名榜首,这些都指示了一个大名鼎鼎的药物,阿达木单抗。阿达木单抗是一种拮抗肿瘤坏死因子α(TNFα)的单克隆抗体,截止当前全球获批了包括类风湿性关节炎、强直性脊柱炎、克罗恩病、银屑病在内的17个适应症。国内也有生物类似药获批上市,大大增加了中国患者的可及性。面对这样一个超级明星药物,治疗药物监测又能为它做些什么呢?
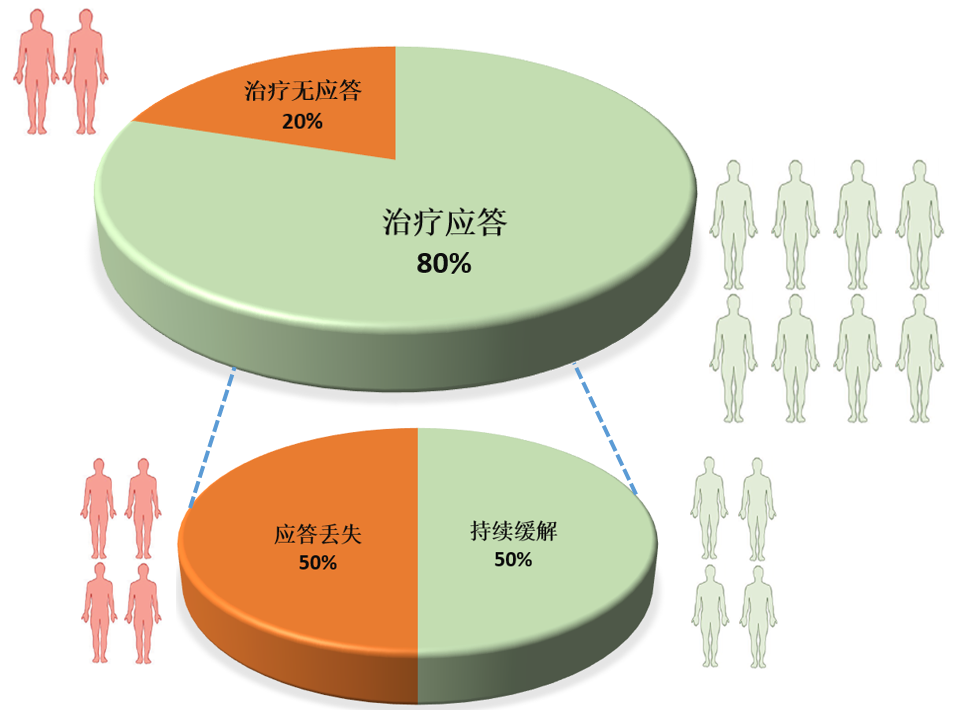
在炎症性肠病患者治疗中的数据显示约20%的患者对阿达木单抗治疗无应答,近一半的患者会在维持期治疗中出现应答丢失。打个比方:10名患者接受治疗12周后,有2名患者的临床症状得不到改善,其余8名患者可以得到较好的疾病缓解;在后续的维持治疗过程中,疾病缓解的8名患者中会有4名患者出现疾病复发,只有4名患者可以得到长期的疾病持续缓解。
出现这两种情况常见的原因可能有二:一是疾病的发生、发展主要不是TNFα所介导;二是患者体内暴露是否充足,这其中又有可能因为抗药抗体的产生导致的药物暴露不足。目前的研究和指南表明在原发无应答和继发失应答的情况下进行治疗药物监测(TDM)有助于治疗决策。简单来说就是患者在使用了阿达木单抗之后,通过采集血样进行血药浓度暴露和和抗药抗体水平评估在支持医生对治疗方案的优化。

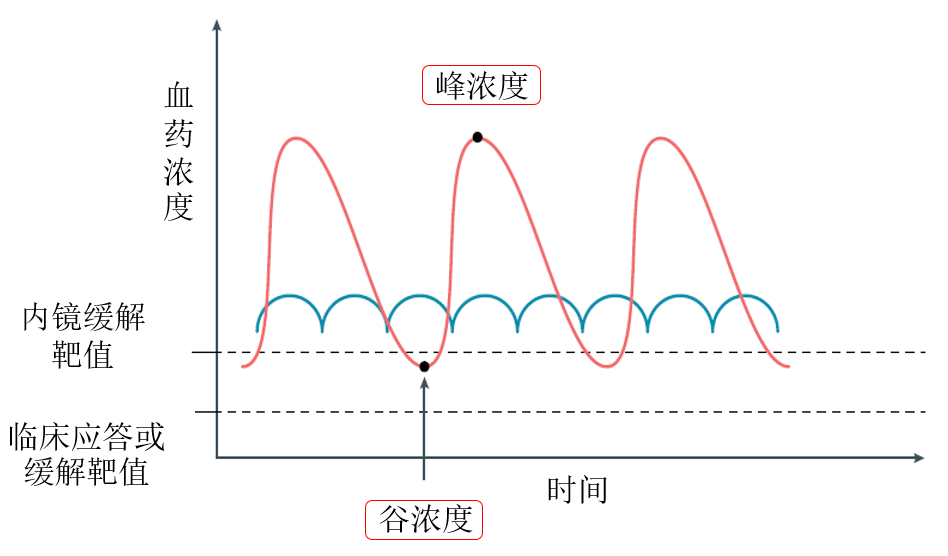
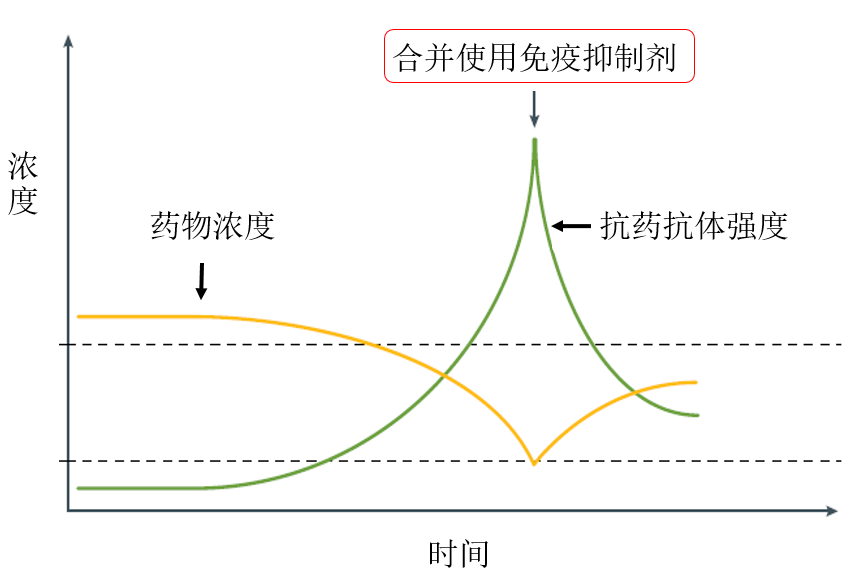
TDM的理论基础是通过体内暴露程度来实现用药方案最佳化。阿达木单抗给药后的药时曲线会类似于下图中蓝色线条,会出现峰谷浓度,对于克罗恩疾病来说我们需要控制阿达木单抗谷浓度处于内镜缓解靶值以上,保证最好的疗效。
那对于阿达木单抗血药浓度低于靶值,可以采取的措施是缩短给药间隔或是增加剂量,从而可以控制谷浓度维持在靶值以上。
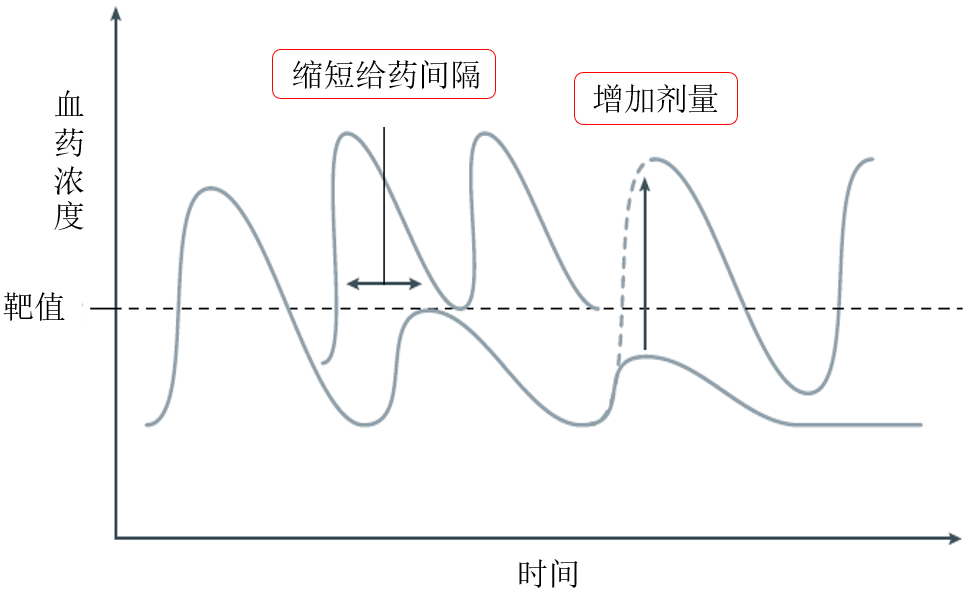
一旦出现血药浓度下降,而抗药抗体强度在升高的情况,通过合并使用免疫抑制剂可以有效的抑制抗药抗体的生成从而恢复血药浓度,产生协同作用。缩短给药间隔、增加剂量或是合并使用免疫抑制剂这3种方式称之为升级治疗策略。
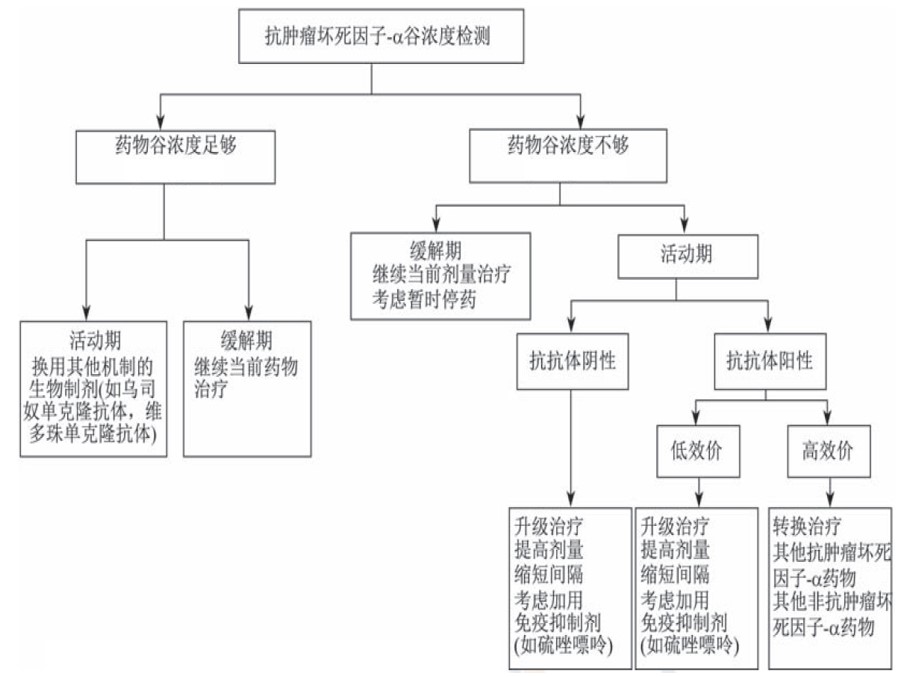
基于这些理论,如何根据TDM结果优化治疗方案,可以总结如下文字和策略树:
经规范治疗后仍处于活动期患者,可根据TDM结果调整治疗策略:
1. 如果患者药物谷浓度在治疗窗内,建议转换其他作用机制的药物。
2. 药物谷浓度低于治疗窗浓度,但未检测到抗药抗体或抗药抗体效价较低,可增加阿达木单抗剂量,或缩短用药间隔,或联用免疫抑制剂。
3. 药物谷浓度不足,且抗药抗体效价较高,建议转换其他作用机制的治疗药物。
对于缓解期患者,根据TDM结果调整治疗策略:
1. 药物谷浓度在治疗窗内,维持当前药物和治疗剂量不变。
2. 药物谷浓度低于治疗窗浓度,可结合临床情况维持原治疗剂量,或考虑给予停药。
3. 药物谷浓度过高,可结合临床情况适当减少药物剂量。
【注意事项】
ü 治疗窗:阿达木单抗有效谷浓度推荐为5-12 μg/mL,需要注意的是达到组织学缓解的药物暴露高于内镜下缓解、高于生物学缓解;对于抗药抗体的检测数值,目前没有统一标准,也缺乏临床相关抗药抗体浓度的阈值。因此需要结合血药浓度、抗药抗体水平和疾病活动度综合制定决策。
ü 采样时间:尽可能在接近下次给药之前进行药物浓度及抗药抗体监测,通常在下次注射前24h内采集样本。
ü 检测方法:同一患者建议使用同一种检测方法,以使前后的检测结果更具可比性,以便判断监测结果的临床意义。
ü 抗药抗体检测频次:有些患者体内的抗药抗体可能是一过性的,短暂性抗药抗体可自行消失且与药物的临床疗效无关,不会导致患者出现继发失应答,建议重复检测有利于治疗决策。
参考文献:
[1] Dreesen E, Bossuyt P, Mulleman D, Gils A, Pascual-Salcedo D. Practical recommendations for the use of therapeutic drug monitoring of biopharmaceuticals in inflammatory diseases. Clin Pharmacol. 2017;9:101-111.
[2] Argollo M, Kotze PG, Kakkadasam P, D'Haens G. Optimizing biologic therapy in IBD: how essential is therapeutic drug monitoring?. Nat Rev Gastroenterol Hepatol. 2020;17(11):702-710.
[3] Gibson DJ, Ward MG, Rentsch C, et al. Review article: determination of the therapeutic range for therapeutic drug monitoring of adalimumab and infliximab in patients with inflammatory bowel disease. Aliment Pharmacol Ther. 2020;51(6):612-628.
[4] Papamichael K, Cheifetz AS, Melmed GY, et al. Appropriate Therapeutic Drug Monitoring of Biologic Agents for Patients With Inflammatory Bowel Diseases. Clin Gastroenterol Hepatol. 2019;17(9):1655-1668.e3.
[5] Mitrev N, Vande Casteele N, Seow CH, et al. Review article: consensus statements on therapeutic drug monitoring of anti-tumour necrosis factor therapy in inflammatory bowel diseases. Aliment Pharmacol Ther. 2017;46(11-12):1037-1053.
[6] Feuerstein JD, Nguyen GC, Kupfer SS, Falck-Ytter Y, Singh S; American Gastroenterological Association Institute Clinical Guidelines Committee. American Gastroenterological Association Institute Guideline on Therapeutic Drug Monitoring in Inflammatory Bowel Disease. Gastroenterology. 2017;153(3):827-834.
[7] 中华医学会消化病学分会炎症性肠病学组. 中国炎症性肠病治疗药物监测专家共识意见. 中华消化杂志. 2018;38(11):721-727.
相关文章
- 第十届全国治疗药物监测学术年会“药物治疗风险管理分论坛”成功举办 ... ... ...
- 第十届全国治疗药物监测学术年会定量药理学分论坛顺利召开 ... ... ... ...
- 第十届全国治疗药物监测学术年会TDM分析技术论坛成功举办
- 第十届全国治疗药物监测学术年会Workshop2分论坛顺利召开
- 第十届全国治疗药物监测学术年会神经精神TDM分论坛成功举办 ... ... ...
- 第十届全国治疗药物监测学术年会“TDM与循证药学分论坛”顺利举行 ... ...
- 第十届TDM全国学术年会临床药师个体化分论坛顺利举办
- 第十届全国治疗药物监测学术年会国际分论坛顺利举办
- 第十届全国治疗药物监测学术年会青委会分论坛顺利举办
- 第十届全国治疗药物监测学术年会基层药师治疗药物监测分论坛顺利召开 ... ...
- 关注大分子抗体类药物的体内浓度测定和临床合理使用
- 第十届全国治疗药物监测学术年会儿童TDM分论坛顺利召开







